Gaz Klor Nötralizasyon (Scrubber)
Gaz Klor Nötralizasyon

Bütüncül çevre koruma programına uymak ve risk yönetimini doğru uygulamak adına gaz kaçağını engellemek için klor içeren sistemlerde scrubber (yıkama - nötralizasyon) sistemleri kurmak gereklidir.
Yıkama Kimyasalları ve Oluşan Yan Ürünler
Bir scrubber sisteminde aşağıdaki yıkama kimyasalları kullanılabilir :
- Sodyum Hidroksit
- Potasyum Hidroksit
- Sodyum Karbonat
- Calsiyum Hidroksit
- Sodyum Sulfit
- Sodyum Tiyosülfat
- Demir Klorür
- Adsorbe edici maddeler
Klor yıkama uygulaması kimyasal bir prosestir ve reaksiyonlar, ısı üretimi, çıkan ürünler, atıkların uzaklaştırılması, kimyasalların güvenli bir şekilde taşınması konularında dikkat gereklidir.
Kimyasal Tepkimeler
Klorun Sodyum Hidroksit solusyonuna eklenmesi ile aşağıdaki reaksiyon oluşur:
2NaOH + Cl2 ⇒ NaOCl + NaCl + H2O
NaOH : Sodyum Hidroksit
NaOCl : Sodyum Hipoklorit
NaCl : Tuz (Sodyum Klorür)
Ağırlık bazında 0.454 kg klor + 0.512 kg sodyum hidroksit 0,477 kg sodyum hipoklorit oluşturur.
Devamında Sodyum Hipoklorit aşağıdaki şekilde çözünebilir :
3NaOCl ⇒ NaClO3 + 2NaCl
2NaOCl ⇒ 2NaCl + O2
Kostik içermeyen solusyona sürekli olarak klor eklenirse, solusyon klora doygun hale geçecektir. (pH, sıcaklık ve iyon konsantrasyonuna bağlı olarak). Solusyon klora doygun hale geldiğinde ise scrubberdan dışarıya klor çıkışı yaşanır. Eğer kostik solusyonda tamamen tükenmiş ise tüm klor scrubberdan dışarıya arıtılmadan atılacaktır. Klorun böyle bir solusyona beslenmesine devam edilirse solusyonda aşağıdaki reaksiyonlara bağlı olarak asit oluşacak ve pH değeri düşecektir.
NaOCl + Cl2 + H2O ⇒ 2HOCl + NaCl
Cl2 + H2O ⇔ HOCl + HCl
2HOCl + NaOCl ⇒ NaClO3 + 2HCl
pH 5'in altına düştüğünde aşağıdaki reaksiyon gerçekleşir ve HOCl, HCl 'e dönüşmeye başlar:
2HOCl ⇒ 2HCl + O2
Yeteri kadar HCl oluştuğunda klor gazı solusyondan kurtularak havaya karışır:
HOCl + HCl ⇔ H2O + Cl2
Aşırı klorlanmış solusyona gelen klor akımı durdurulduğunda klor yukarıdaki reaksiyon gereği pH değeri 5'in üzerine çıkana kadar HCl tüketerek solusyondan serbest kalacaktır.
Reaksiyon Sıcaklıkları
Sıcaklık klor scrubberlarında dizayn ve işletme sırasında büyük önem taşır.
Scrubber Reaksiyonu
Sodyum hidroksit - klor reaksiyonunda yüksek oranda ısı açığa çıkar:
2NaOH + Cl2 ⇒ NaOCl + NaCl +H2O
ΔH25 = -626 Btu/lb (-348 cal/g) klor gazı
Sodyum Hipokloritin Çözünme Reaksiyonları
NaOCl ⇒ NaCl + ½O2 [E2-9]
ΔH25 = -336 Btu/lb (-187 cal/g) Hipoklorit çözünmesi
3NaOCl ⇒ NaClO3 + 2NaCl [E2-2]
ΔH25 = -188 Btu/lb (-104 cal/g) Hipoklorit çözünmesi
Yukarıdaki reaksiyon ısıları 77°F (25°C)'de aşağıdaki değerlere göre hesaplanmaktadır:
ΔH25 NaOH = -112.93 kcal/g ⋅ mol
ΔH25 NaCl = -97.234 kcal/g ⋅ mol
ΔH25 H2O = -68.3174 kcal/g ⋅ mol
ΔH25 NaOCl = -83.39 kcal/g ⋅ mol
ΔH25 NaClO3 = -78.92 kcal/g ⋅ mol
526 Btu/lb (292 cal/g) klor gazı olacaktır.
Sıvı klorun buharlaşma ısısı oda sıcaklığında 100 Btu/lb (55 cal/g)'dır.
%20 lik başlangıç konsantrasyonuna sahip bir kostik solusyonu ile yıkama yapılması durumunda klorun çeşitli hallerinde son sıcaklık aşağıdaki eğrilerde gösterilmektedir:

Diğer Detaylar
Sistem içinde katılaşma ve bu sebeple sistem komponentlerinde tıkanmalar olması engellenmelidir. Donma, yabancı maddeler ve aşağıdaki mekanizmalar nedeniyle scrubber sisteminde katılar oluşabilir:
Kostik Soda ve Katı Tuz Oluşumu
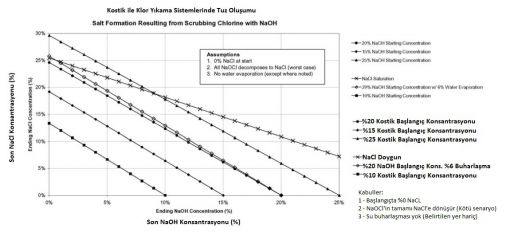
Sodyum hidroksit (kostik soda) klor içeren gazların absorbsiyonunda sıklıkla kullanılır. Klor ile kostik reaksiyona girdiğinde tuz oluşur. Tuz scrubber solusyonunda çözünmesi zor bir maddedir. Bu nedenle kostik tükendiğinde tuz çökebilir. Scrubber solusyonu olarak ticari kostik kullanılıyorsa ve bu solusyon içinde tuz bulunabildiğinden tuz çökelmesi artabilir. Kostik ve klor reaksiyona girdikçe su buharlaşacak ve yine aynı sorunda artış yaşanabilecektir.
%20 giriş konsantrasyonundaki kostik solusyonu kullanıldığında ancak kostik tamamen tükendiğinde tuz çökelmesi yaşanabilir.
Daha yüksek konsantrasyonlar kullanılırsa çıkış kostik konsantrasyonu çok daha yüksek kalacağından katı tuz oluşumu engellenebilir.
Kostik Soda ve Karbondioksit (CO2)
Karbondioksit klor yıkama sisteminde havadan sisteme karışan bir kirliliktir. Kostik ile aşağıdaki reaksiyona girerek sodyum karbonat ve sodyum bi karbonat oluşmasına neden olur :
2NaOH + CO2 ⇒ Na2CO3 + H2O (pH>12)
NaOH + CO2 ⇒ NaHCO3 (pH<12)
Sodyum karbonatın scrubber solusyonu içinde çözünürlüğü düşüktür. sodyumbi karbonatın ki ise daha da düşüktür.
Bu nedenle karbondioksit varlığında veya kostik solusyonunun atmosferle temas etmesi durumunda tuzlar oluşabilir. Scrubber dizaynı ve işletilmesi özellikle pH değerinin 12 'den düşük olacağı tahmin ediliyorsa katılar ile müdahale edileceği göz önüne alınarak yapılmalıdır.
Aynı şekilde kondensasyon ve seyreltme sıcaklıkları da dikkat edilmesi gereken hususlardandır.
Bozunma
Termal Bozunma
Hipoklorit solusyonunun ayrışması sıcaklık ile artar.
Yüksek hipoklorit konsantrasyonları ve düşük bakiye kostik var ise de ayrışma artacaktır.
Sonuçta sodyum hipokloritten oksijen ve tuz oluşumu görülür.
Katalitik Bozunma
Metal iyonlarının varlığında (kobalt, nikeli bakır, demir) hipoklorit solusyonu ayrışması katalitik olarak hızlanır.
Tuzların varlığında bu elementler ile birleşerek ısı açığa çıkarırlar ve hipoklorit neredeyse tamamen ayrışır. Birçok metalin atıksu deşarj yönetmeliklerine göre deşarjı izne tabidir.
Zaman ve Işık ile Bozunma
Tüm hipoklorit solusyonları zamanla ayrışır. Güneş ışığı prosesi hızlandırır. Bazı durumlarda sundurmalıklar zayıf hipoklorit solusyonlarının ayrışmasını düşürmek için kullanılır.
Kimyasal Bozunma
Bazı kimyasalları hipoklorit ile tepkimeye girerler.
- Sülfürdioksit (SO2)
- Sülfitler (Na2SO3, NaHSO3)
- Tiyosülfat
- Hidrojen Peroksit
Atık asitler kloru geri kazanmak için tüketilen yıkama sıvısı ile birleştirilebilir ve klor prosese geri verilebilir. Sodyum hipoklorit ile asitlerin reaksiyonu (HCl ve H2SO4) klor gazı oluşmasına neden olur.
Gaz Klor için Kostik ile Yıkama (Scrubber) Sistem Dizaynı
Dizayn Kapasitesi
Yıkanacak klor miktarına göre belirlenmelidir. Bir durum sırasında sisteme verilebilecek Sodyum Hipokloritin miktarı ile sınırlıdır. Genellikle ulaşılabilir kostik hacmine göre kontrol edilir.
Dizayn Oranı
Belirli bir zamanda verilebilecek klor kütlesi oranıdır. Dozlanabilecek Sodyum Hipoklorit oranı ile sınırlıdır. Klor akımı kesikli ise yıkama sıvısının dizayn oranı stokiyometrik olarak pik klor akımı ile istenen bakiyenin toplamına eşittir.
Örneğin, 3 saat süre ile basınç emniyet cihazı scrubber sistemine hava veriyor ve pik klor debisi 4500 kg/saat olsun. %10 bakiye yıkama sıvısı isteniyor.
Dizayn oranı (eğer yıkama için sodyum hidroksit kullanılıyor ise) 4500 x 1.128 (kostik / klor moleküler ağırlık oranı ) x 1,1 (%10 bakiye) = 5584 kg/saat kadar %100 lük sodyum hipoklorit olmalıdır.
Dizayn kapasitesi ise 3 saat x 5584 kg/saat = 16752 kg/saat %100 kostiktir.






